빛을 쪼여서 암세포를 공격하는 광역동 치료를 안전하게 쓸 방법이 나왔다. 생체에 무해하고 안정한 ‘나노젤(Nanogel)’을 써서 체내 부작용을 줄인 시스템이다.
유니스트(UNIST·울산과학기술원) 화학과 권태혁 교수팀은 정상세포 환경에선 안정하게 항암제를 보관하고, 빛이 쬐어진 암세포 환경에서만 항암제를 방출하는 ‘나노젤 광감각제 시스템’을 개발했다고 15일 밝혔다.
광역동 치료는 빛에 반응해 활성산소(독성)를 만드는 광감각제로 암세포를 사멸하는 방법이다. 광감각제가 활성산소를 더 많이 만들게 하려고 중금속을 연결하는 방법이 많이 쓰이는데, 이 경우 체내 부작용이 야기된다. 중금속과 연결된 광감각제의 자체 독성이 혈액 순환 중에 정상세포의 기능을 저해할 수 있는 것이다.
권태혁 교수팀은 이 문제를 해결하기 위해, 물에 잘 녹으면서 생체에도 적합한 ‘고분자 기반 나노젤’로 광감각제를 감싸는 방법을 선택했다. 나노젤은 정상적인 환경에서 광감각제를 보호해 체내 독성을 줄이고, 치료가 필요한 암세포에 빛을 쪼이면 활성화돼 독성을 높였다.
제1저자인 이채규 유니스트 화학과 석·박통합과정 연구원은 “빛을 이용해 종양 등 원하는 부위에서만 광감각제의 독성이 보이는 것은 ‘산화-환원 반응의 가역성’과 ‘나노젤의 소수성 상호작용’을 이해하고 정밀하게 조절한 결과”라고 밝혔다.
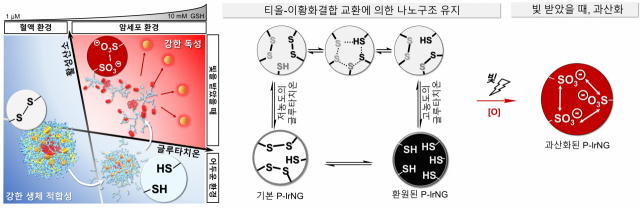
이번에 개발한 나노젤 물질은 소수성 방향족 고리와 친수성 고분자 구조로 이뤄지는데, 소수성 고리 개수가 많을수록 더 많은 광감각제를 안정적으로 담는다. 또 이 물질은 빛을 주지 않으면 정상세포와 암세포 환경에서 24시간 동안 모양과 크기를 유지했다.
공동으로 연구를 주관한 김병수 연세대 교수는 “생체에 적합한 고분자를 이용해 나노젤을 만드는 과정에서 티올기(-SH)와 이황화결합(S-S)의 산화-환원 가역반응을 이용했다”며 “두 물질이 서로 가까울 때 나타나는 산화-환원 가역반응은 어두운 환경에서 나노젤이 모양을 유지하는 데에 큰 도움을 준다”고 설명했다.
모양을 잘 유지하던 나노젤은 암세포에서 빛을 받으면 작동을 시작한다. 빛을 받은 광감각제가 활성산소를 과량 생성하고, 이 영향으로 나노젤 속 티올기가 슬폰산기로 바뀌는 것. 슬폰산기는 음전하를 띠어 서로 밀어내다가 나노젤을 분해해버린다. 이때 독성을 가진 광감각제가 방출돼 암세포를 공격하는 원리다.
권태혁 교수는 “광감각제를 담은 나노젤의 분해를 빛과 암세포 내 환경을 이용해 시공간적(spatiotemporal)으로 제어했다”며 “광감각제가 암만 골라 공격하도록 선택성을 높임으로써 암 환자의 치료 부작용을 줄이는 중요한 분자공학적 전략이 될 것”이라고 설명했다.
이번 연구는 화학 분야 권위지인 앙게반테 케미(Angewandte Chemie International Edition) 9월 12일자 온라인 출판됐다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >










 jjs@sedaily.com
jjs@sedaily.com







































