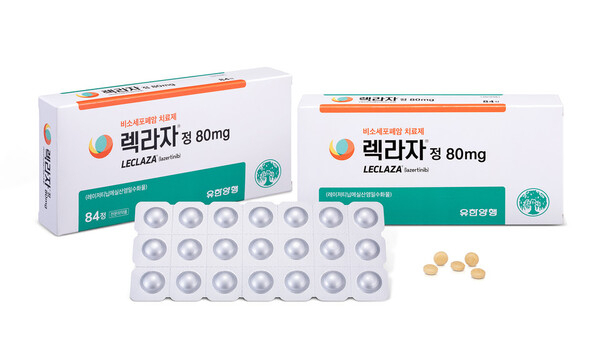
해외 제약사 얀센이 유한양행(000100)으로부터 도입한 비소세포폐암 치료제 ‘레이저티닙(국내명 렉라자)’의 약물 상호 작용을 평가하는 새로운 글로벌 임상에 착수했다. 통상 미국 식품의약국(FDA)이 의약품 개발업체가 신약허가신청 서류를 제출할 때 약물 상호 작용 평가 임상 자료를 요구한다는 점을 감안할 때 얀센이 레이저티닙의 FDA 허가신청을 위한 준비절차에 돌입했다는 분석이 나온다.
25일 미국 국립보건원(NIH)이 운영하는 임상정보 등록사이트 클리니컬트라이얼즈에 따르면 얀센은 최근 레이저티닙 관련 글로벌 1상 임상 시험 계획을 신규 등록했다. 건강한 성인 20명을 대상으로 레이저티닙과 수면마취제 ‘미다졸람’·고지혈증 치료제·‘로수바스타틴’·당뇨병 치료제 ‘메트포르민’의 약물상호작용을 평가하는 연구다. 체내에서 약물상호작용을 유발할 수 있는 약물을 병용 투여하고 레이저티닙의 농도 변화를 측정한다. 얀센은 지난 9월부터 임상 대상자 모집에 돌입해 올해 말까지 임상시험을 완료할 계획이다.
FDA가 의약품 개발업체로부터 약물상호작용 평가임상 자료를 요구하는 것은 환자가 기존에 처방받던 약물과 함께 신약을 복용했을 때 혹시 모를 이상반응 발생에 대비하기 위해서다.
얀센이 4건의 병용임상을 동시 가동하면서 개발 속도를 높이는 것도 이 같은 움직임에 힘을 싣고 있는 것으로 평가된다. 얀센이 지난 9월 유럽종양학회에서 발표한 CHRYSALIS-2 1b상 임상 결과에 따르면 레이저티닙과 ‘아미반타맙’을 병용 투여한 비소세포폐암 환자 29명 중 12명이 부분반응(PR)을 나타냈다. ‘오시머티닙(국내명 타그리소)’, 항암화학요법 등 다양한 약제를 투여받으면서 상태가 악화한 전이성 폐암 환자를 상대로 높은 반응률(ORR)을 확보하면서 FDA 승인 확률이 높아졌다는 분석이다. 국내에서 레이저티닙 병용 임상을 총괄하고 있는 조병철 연세대 의대 종양내과 교수는 “레이저티닙 병용 투여로 제로에 가깝던 난치성 폐암 환자의 반응률이 41%까지 높아졌다”며 “이런 효능이 유지될 경우 연말 FDA 혁신의약품지정(BTD)을 받고 내년 가속승인도 가능할 것”이라고 내다봤다.
유한양행은 레이저티닙의 글로벌 매출액을 연간 10억 달러(1조 1,000억 원) 규모로 예상하고 있다. 4차치료제로 첫 허가를 받으면 연매출 10억 달러 시장에 진입하고, 차츰 적응증을 추가하면서 시장 규모를 4~5배 키워나갈 계획이다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >









 realglasses@sedaily.com
realglasses@sedaily.com