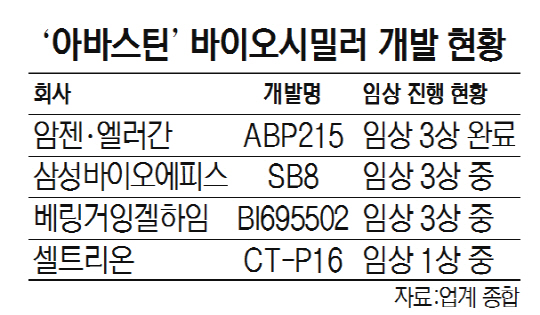
전 세계 의약품 중 매출 7위인 아바스틴(바이오의약품)의 미국 특허만료가 2년 앞으로 다가오면서 복제약 시장 선점을 위한 바이오 기업들의 주도권 경쟁이 치열하다. 이미 출사표를 던진 암젠, 삼성바이오에피스, 베링거잉겔하임에 이어 셀트리온까지 임상에 뛰어들면서 ‘4파전 구도’가 형성됐다. 업계에서는 “암젠·엘러간과 삼성바이오에피스가 가장 앞서 있지만 누가 먼저 판매 승인을 받을 수 있을지 섣불리 판단하기 힘들다”는 입장이다.
18일 관련 업계에 따르면 셀트리온은 전날 식품의약품안전처로부터 아바스틴 바이오시밀러 ‘CT-P16’의 임상 허가를 받고 본격적인 임상 1상에 돌입했다. 이번 임상은 오리지널 의약품 아바스틴이 미국과 유럽에서 승인받은 임상 내용과 대조해 효능을 입증하는 과정으로 진행된다. 바이오시밀러는 임상 2상이 면제되기 때문에 셀트리온은 한국에서 임상 1상을 마친 후 곧바로 임상 3상에 나선다는 계획이다. 셀트리온은 내년 판매 승인을 목표로 임상 3상 중에 미국 식품의약처(FDA)에 판매 허가를 신청한다는 전략이다. FDA는 임상을 마치기 전에도 최소한의 요건만 갖추면 미리 판매 허가를 신청할 수 있다.
현재 아바스틴의 바이오시밀러는 미국 바이오기업 암젠과 엘러간이 공동 개발 중인 ‘ABP215’가 가장 앞서 있다. 두 회사는 지난해 11월 임상 3상을 마치고 FDA에 이미 판매허가를 신청한 상황이다. 삼성바이오에피스는 지난해 5월 ‘SB8’의 글로벌 임상 3상을 시작했고 베링거잉겔하임도 지난해 11월 ‘BI695502’의 임상 3상에 뛰어들었다.
아바스틴은 로슈의 자회사 제넨텍이 지난 2004년 출시한 표적항암제다. 처음에는 대장암 치료제로 개발했지만 폐암, 신세포암, 교모세포종, 자궁경부암, 유방암 등에도 효능을 입증받았다. 지난해 매출 규모가 67억5,200만 달러(약 7조6,300억원)로 전체 의약품 중 7번째로 많이 팔렸다. 국내 시장 규모는 500억원대다. 아바스틴의 특허만료는 미국이 2019년 7월, 유럽은 2020년 1월까지다.
업계의 한 관계자는 “현재는 암젠·엘러간과 삼성바이오에피스가 첫 아바스틴 바이오시밀러의 미국 출시에 가장 앞선 상황”이라며 “늦게 출발한 셀트리온도 임상을 단기간에 마치면 특허만료 이전에 판매승인을 받을 수도 있다”고 말했다.
/이지성기자 engine@sedaily.com
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >