비용 문제로 ‘킴리아’ 치료를 받지 못했던 소아·청소년 백혈병 환자들이 임상 시험에 참여할 수 있는 기회가 마련됐다. 서울대병원이 국내 병원 최초로 키메라 항원 수용체 T세포(CAR-T) 생산에 나서면서 환자들의 접근성이 높아질 것으로 기대된다. 국내 병원이 CAR-T 치료제를 자체 생산해 임상연구를 진행하는 것은 이번이 처음이다.
서울대병원은 소아청소년 급성림프모구백혈병 환자 대상 CAR-T 치료 임상연구를 승인 받았다고 9일 밝혔다.
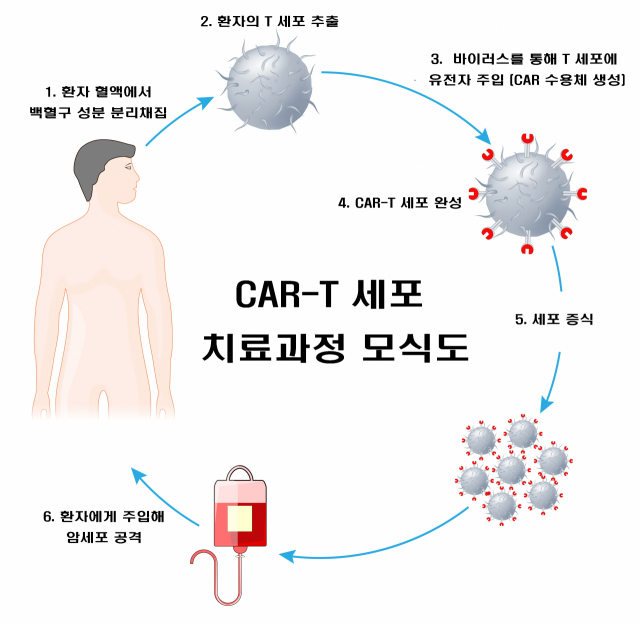
CAR-T는 체내 면역을 담당하는 T세포를 추출한 다음 항체의 바이러스 벡터를 활용해 암세포에 특이적인 키메릭 항원 수용체(CAR)를 발현시키고 재주입하는 새로운 방식의 항암제다. 면역세포가 암세포만을 정확하게 표적할 수 있도록 만들어 체내 정상세포 손상을 최소화하는 획기적인 치료법으로 주목받고 있다.
서울대병원은 올해 4월 임상연구계획을 제출하고 약 8개월 만에 승인을 받았다. 작년 9월 '첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법령'(첨단재생바이오법) 시행 이후 국내에서 고위험 첨단재생의료 임상연구가 승인받은 첫 사례다. 의료 현장에서는 재발·불응성 소아청소년 급성림프모구백혈병 환자의 치료 접근성이 크게 높아질 것이란 기대감이 높다. 앞서 노바티스의 CAR-T 치료제 '킴리아'가 지난 3월 식품의약품안전처의 허가를 받았지만, 회당 5억 원에 달하는 비용 탓에 실제 혜택을 받는 환자는 상당히 제한적이었다. 이번 승인으로 임상 연구에 참여하는 환자들은 서울대병원에서 생산한 CAR-T 치료제를 무상으로 공급받을 수 있다. 킴리아의 경우 그동안 환자의 T세포를 해외로 보내고 증식해 다시 주입하기까지 평균 3주가 소요됐지만, 이제는 서울대병원이 직접 생산하기 때문에 평균 12일로 단축될 수 있다.
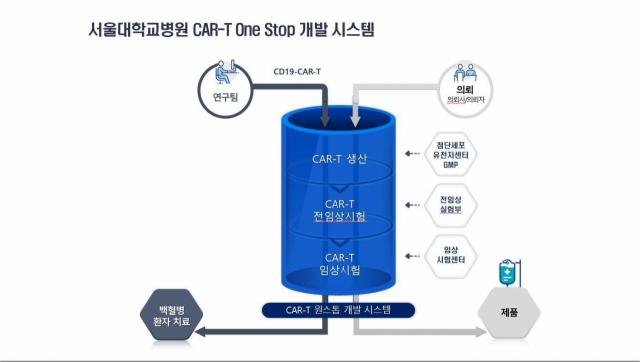
서울대병원은 국내 연구자들이 개발한 CAR-T 치료제가 환자들에게 쉽게 적용될 수 있도록 병원 자산을 활용해 ‘GMP 생산-전임상시험-임상시험’ 전 과정을 한꺼번에 진행할 수 있는 CAR-T 개발 원스톱 시스템을 준비 중이다. 소아 백혈병을 넘어 여러 질환군에서 CAR-T 치료제를 개발하기 위해 노력할 예정이다.
이번 연구 책임자인 강형진 서울대병원 소아청소년과 교수는 "국내 최초의 연구인만큼 오랜 심의를 거쳤다"며 "그동안 비용 부담으로 CAR-T 치료를 받지 못한 국내 소아청소년 백혈병 환아들에게 희망이 되기를 기대한다”고 말했다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >









 realglasses@sedaily.com
realglasses@sedaily.com






































