처음으로 미국 식품의약국(FDA)에서 호중구 감소증 치료제인 롤론티스(롤베돈)의 품목 허가를 획득한 한미약품(128940)이 반등에 성공했다. 증권가는 5조 원까지 커질 것으로 예상되는 호중구 감소증 치료제 시장에서 다른 경쟁 약물보다 뛰어난 약효를 가진 롤론티스가 시장 점유율을 빠르게 높여갈 것으로 전망한다.
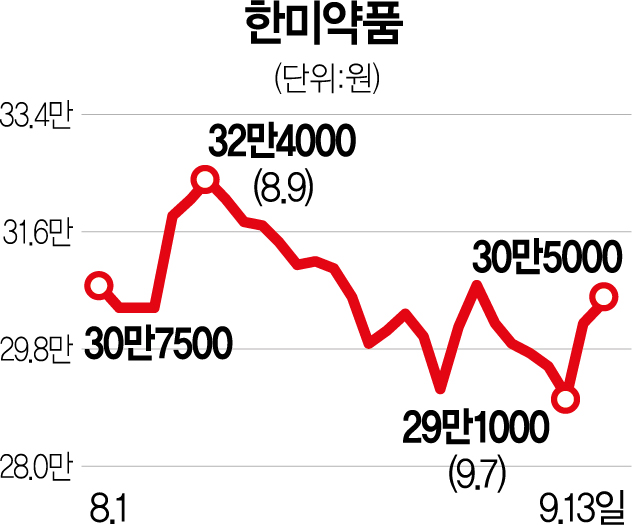
13일 한국거래소에 따르면 한미약품은 전 거래일보다 3000원(0.99%) 오른 30만 5000원에 거래를 마쳤다. 이날 한미약품은 장중 32만 6500원(8.11%)까지 급등하기도 했다. 다만 차익실현 매물이 출회하면서 상승폭을 대부분 반납하며 장 마감했다.
한미약품이 투자자들의 관심을 모은 배경은 한미약품의 신약인 롤론티스가 국내에서 6번째로 FDA의 승인을 받았다는 점이다. 앞서 한미약품은 파트너사인 미국 바이오 업체 스펙트럼이 9일(현지 시간) FDA에서 호중구 감소증 치료제인 롤론티스의 품목 허가를 받았다고 밝혔다. 한미약품이 개발한 신약이 FDA에서 품목 허가를 받은 것은 처음이며 국내 제약사가 개발한 신약 중에서는 여섯 번째 사례다. 롤론티스는 백혈구 내 호중구가 비정상적으로 감소한 암 환자에게 사용되는 치료제다.
임윤진 대신증권 연구원은 “롤론티스와 경쟁 약물의 비교 임상 3상 결과 항암 사이클 1에서 중증 호중구 감소증 지속 일수가 최대 0.15일 단축됐다”며 “중증 호중구 감소증이 나타나지 않은 환자의 비율도 84%로 경쟁 약물의 76%보다 높아 비열등성이 입증됐다”고 말했다. 그는 “롤론티스 원료 의약품은 한미약품의 평택 바이오 공장에서 생산돼 공급 중인데 이에 따라 향후 매출액 확대로 인한 영업 레버리지 개선 및 수익성 확대도 가능하다”고 덧붙였다.
한미약품의 두 번째 FDA 품목 허가 신약이 탄생할 수 있다는 기대감도 커지는 중이다. 유럽종양학회에서 한미약품은 비소세포폐암 치료제인 포지오티닙에 대한 임상 중간 결과를 발표했는데 긍정적 결과라는 판단이 우세해 FDA 추가 품목 허가 가능성이 커진 것이다. 엄민용 현대차증권 연구원은 “포지오티닙은 11월 24일 FDA 승인이 완료되면 엑손20 삽입 변이 비소세포폐암 환자 대상 최초의 승인 치료제”라며 “이 경우 한미약품은 한 해에 FDA로부터 2개의 신약 허가를 받는 회사가 된다”고 말했다.
증권가는 한미약품의 신약 개발 성공 기대감이 높아졌다는 점을 근거로 목표 주가를 상향했다. 현대차증권은 기존 37만 원이던 목표 주가를 39만 원으로, 삼성증권은 35만 원에서 36만 원으로 상향했다. 서근희 삼성증권 연구원은 “신약 가치 2390억 원을 반영해 목표 주가를 조정했다”면서도 “한미약품 생산 및 롤론티스 로열티 관련 초기 매출 성장은 다소 더딜 것으로 판단한다”고 말했다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >









 door@sedaily.com
door@sedaily.com