이중항체 전문 기업 에이비엘바이오는 파킨슨병 등 퇴행성뇌질환 치료 이중항체 후보물질 ‘ABL301’의 임상 1상 시험계획서(IND)를 지난달 30일 미국 식품의약국(FDA)에 제출했다고 4일 밝혔다.
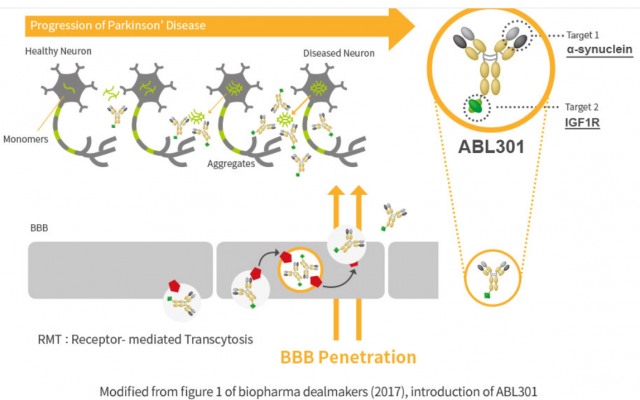
ABL301은 파킨슨병의 발병 원인인 알파-시뉴클레인(alpha-synuclein) 축적을 억제하는 항체를 뇌 안으로 전달해 치료 효과를 높인 이중항체 후보물질이다. 에이비엘바이오의 ‘그랩바디-B(Grabody-B)’ 플랫폼 기술을 적용해 도출했다.
그랩바디-B 플랫폼은 ‘IGF1R’을 타깃해 다양한 중추신경계(CNS) 질병에 대한 치료제 후보물질의 혈액뇌관문(Blood-Brain Barrier·BBB) 침투 능력을 극대화한다.
에이비엘바이오는 이번 임상에서 만 18세부터 55세 사이의 건강한 성인 남녀 68명을 대상으로 ABL301 단독요법의 안전성 및 내약성을 평가할 예정이다. 에이비엘바이오와 글로벌 제약사 사노피는 올 1월 ABL301에 대한 공동개발 및 기술이전 계약을 체결하고 공동 연구개발위원회를 구성했다.
이상훈 에이비엘바이오 대표는 “퇴행성뇌질환 치료제 개발에 있어 약물의 BBB 투과는 매우 중요한 부분"이라며 "ABL301 임상 1상을 통해 새로운 BBB 셔틀 타깃 IGF1R의 안전성을 확인할 수 있을 것으로 기대한다”고 말했다.
현재 에이비엘바이오는 퇴행성뇌질환 신약으로 BBB 셔틀 플랫폼 그랩바디-B와 이를 활용한 다양한 파이프라인을 개발하고 있다. 면역항암제 분야에서는 그랩바디-T와 그랩바디-I를 기반으로 한 파이프라인을 개발 중이다. 그랩바디-T가 적용된 ‘ABL503’과 ‘ABL111’은 미국에서 임상 1상을 진행하고 있으며 ‘ABL101’과 ‘ABL103’은 내년 임상 1상에 진입할 전망이다. 그랩바디-I 기반 ‘ABL501’은 국내 임상 1상을 진행 중이다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >