|
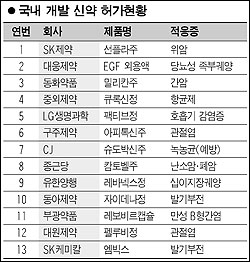
국내 제약회사들이 개발한 신약이 국내는 물론 해외에서 잇달아 시판허가를 앞두고 있어 업계에 새로운 성장동력으로 작용할 전망이다. 특히 일양약품이 개발한 위궤양치료제는 현지 제휴선을 통해 다음 달과 오는 2009년 중국과 미국에서 시판허가를 받을 것으로 예상되고, SK㈜가 존슨앤존슨에 라이선싱한 간질치료제도 2009년 미국에서 신약으로 출시될 전망이어서 상당한 기술이전료 및 로열티 수입이 기대된다. ◇ 일양약품 위궤양치료제 중국에서 신약승인 임박 일양약품이 글로벌시장 공략을 목표로 개발한 위궤양치료제 ‘일라프라졸’은 내년 국내 출시에 앞서 이르면 다음 달 세계 최초로 중국에서 신약 승인을 받아 출시될 것으로 예상된다. 일양약품 관계자는 “중국에서 임상시험을 끝내고 지난해 4월 보건당국에 신약 승인을 신청했지만 중국 내 의약품 리베이트 파문이 불거져 허가업무가 올 스톱되는 바람에 승인이 늦어지고 있다. 하지만 이르면 다음 달 승인이 날 가능성이 높다”고 밝혔다. 일양약품은 일라프라졸에 대한 국내 임상시험이 끝나 이르면 이 달 식품의약품안전청에 신약승인(NDA) 신청을 할 계획이어서 내년 초 ‘14호 국산 신약’이 탄생할 가능성이 높다. 일양약품의 미주지역 협력선인 탭사도 일라프라졸에 대한 현지 2상 임상시험(소규모 환자를 대상으로 한 약효 검증)을 끝내고 보다 많은 환자를 대상으로 한 3상 임상시험을 준비하고 있어 오는 2009년쯤 미 식품의약국(FDA)의 승인을 받아 미국 등에서 시판에 들어갈 전망이다. 이봉호 일양약품 홍보팀장은 “일라프라졸은 탭사가 2009년 특허 만료되는 자사의 위궤양치료제 ‘프레바시드’를 대체할 계획이어서 FDA 승인만 받으면 안정적 매출 확보가 가능, 국내 제약업 역사에 한 획을 그을 획기적 성과가 나올 것”이라고 말했다. 국산 신약 가운데 현재까지 FDA 승인을 받은 제품은 LG생명과학의 항생제 ‘팩티브’가 유일하지만 판매성과는 그리 좋지 못했다. 일양약품에 따르면 일라프라졸은 임상시험 결과 기존 제제보다 적은 용량으로 위궤양ㆍ십이지장궤양 치료 효과가 우수하고 약효 지속시간이 길어 현대인에게 자주 나타나는 스트레스성ㆍ알코올성 궤양, 공복시 속쓰림 등의 증상을 효과적으로 개선시키는 것으로 확인됐다. 해외에 라이선싱한 신약의 상품화도 성과를 내고 있다. SK가 개발해 지난 99년 임상시험 단계에서 다국적제약사인 존슨앤존슨에 라이선싱한 간질치료제 ‘YKP509’의 미국 3상 임상시험이 내년 종료돼 신약으로 출시될 전망이다. SK는 임상단계에 따른 기술이전료를 받았고 제품 출시 후 매출에 따른 로열티를 받게 된다. SK 관계자는 “이 신약에 대한 모든 권리를 존슨앤존슨에 넘겼기 때문에 국내 출시 문제도 존슨앤존슨과 논의하게 될 것”이라고 말했다. ◇ 한미약품, 항암제 신약 개발 박차 한미약품 등 여타 회사들도 국내 신약 개발에 박차를 가하고 있다. 한국신약개발조합에 따르면 현재 신약으로 개발 중인 임상 초기(1~2상) 약물은 24개사 38품목. 개량신약 및 복제 약 개발ㆍ마케팅에 주력해온 국내 2위 제약사 한미약품은 2009년 첫 신약인 항암제 ‘오락솔’을 발매할 계획이다. 오락솔은 항암 주사제로 널리 쓰이는 ‘파클리탁셀’ 성분을 세계 최초로 먹는 제형으로 만든 것. 현재 사람을 대상으로 1상 임상시험(건강한 사람을 대상으로 약물의 기본적인 흡수ㆍ대사ㆍ분포ㆍ배설 등을 평가)을 마치고 2상 임상시험을 준비하고 있다. 항암제는 2상 임상시험만 성공적으로 끝내면 시판허가를 신청할 수 있다. 이관순 한미약품 연구센터 소장은 “1상 임상시험 까지의 결과는 좋다”며 “다만 적응증을 몇 개로 가져갈 것인지에 따라 2상 임상시험 기간이 길어질 수도 있을 것”이라고 말했다. 오리지널 제품의 일부 성분을 변경한 개량신약도 속속 개발되고 있다. 녹십자는 그간 전량 수입에 의존해오던 혈우병(피가 멎지 않는 질병) 치료제 ‘그린진’(가칭) 출시에 전력을 다하고 있다. 그린진은 혈우병의 대부분을 차지하는 8인자 혈우병 치료제. 이 제품이 개발되면 그간 전량 수입에 의존해 오던 혈우병 치료제에도 국산화 시대가 열린다. 현재 최종 임상시험을 마치고 식약청 시판승인을 추진 중이다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >