“한미약품(128940)의 폐암 표적치료제 ‘올리타’는 글로벌 임상2상을 통해 3세대 표적항암제로 인정을 받는 등 일정 부분 성과를 거뒀습니다. 다만 글로벌 시장에서 크게 성공하려면 2상보다 1회 복용량을 줄인 3상에서 유효성(약효)은 유지하되 부작용이 줄어든 결과를 보여주는 게 중요합니다.”
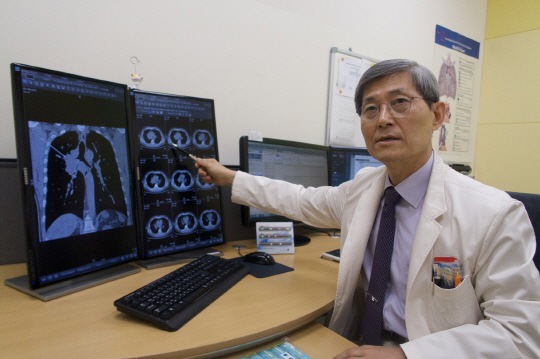
올리타에 대한 글로벌 임상2상을 주도하고 유럽종양학회 아시아세션(ESMO Asia 2017)에서 그 결과를 발표했던 박근칠 삼성서울병원 교수는 5일 “2~3년 뒤쯤 발표될 글로벌 임상3상 결과가 올리타의 경쟁력을 높이는 데 무척 중요한 고비가 될 것”이라고 밝혔다. 박 교수는 삼성서울병원 폐암센터장과 암의학연구소장 등을 지낸 폐암 분야의 명의다.
한미약품은 글로벌 임상3상에서 올리타의 주성분인 올무티닙 800㎎과 600㎎, ‘이레사’ 같은 1세대 표적치료제의 유효성·안전성을 비교평가할 계획이다. 600㎎ 저용량 임상을 함께 시도하는 건 약효는 유지하되 부작용을 줄여 제품 경쟁력과 안전성을 높이기 위해서다. 올리타 800㎎ 1일 1회 복용법으로 실시한 임상2상에서는 환자의 33%, 4%가 이상반응을 보여 중도에 용량을 600㎎, 400㎎으로 줄인바 있다. 한미약품은 이미 식품의약품안전처에 올리타 600㎎ 1일 1회 용법에 대한 유효성·안전성을 평가하는 임상시험(1b상)을 신청해 지난 1일 승인을 받았다.
폐암의 90%가량을 차지하는 비소세포(非小細胞)폐암 치료제인 올리타정은 어떤 존재가치를 가질까. 올리타는 ‘이레사’ 등 상피세포성장인자수용체(EGFR)의 활성을 떨어뜨리는 1세대 티로신키나제억제제(TKI)에 내성, 즉 T790M 돌연변이가 생긴 국소진행성 및 전이성 비소세포폐암 환자에게 투여하는 약이다. 기존 1~2세대 항암제를 10~13개월 복용하다 보면 반 이상에서 내성이 생기기 시작한다. 내성이 생기는 원인의 50~60%는 T790M 돌연변이다.
한미약품은 올리타의 주성분인 올무티닙 800㎎ 1일 1회 용법으로 한국·대만·말레이시아·호주·미국 등 10개국에서 글로벌 임상2상을 끝냈다. 2상에서 T790M 변이 비소세포폐암 환자 162명에게 올리타 800㎎을 1일 1회 투여한 결과 무진행생존기간(PFS)이 중앙값 기준 9.4개월, 전체생존기간(OS)이 19.7개월로 나타났다. 뇌 전이 환자를 포함한 T790M 변이 비소세포폐암 환자들을 치료할 수 있는 3세대 표적항암제라는 평가도 받았다.
박 교수는 “올리타는 이미 한국은 물론 중국·대만·인도·인도네시아·필리핀 등 아시아 대부분의 국가와 동유럽 등에서 타그리소의 비싼 약값을 감당하기 어려운 환자들에게 써볼 만한 효과가 괜찮은 3세대 표적항암제라는 지위를 얻은 셈”이라고 말했다. 그는 “비소세포폐암 환자 중 뇌 전이 환자를 포함한 T790M 돌연변이 환자는 서양인의 경우 10~15%에 불과하지만 동양인은 30~60%나 된다”며 “따라서 아시아 시장의 비중이 클 수밖에 없다”고 덧붙였다. 틈새시장에서는 이미 경쟁력을 갖췄다는 얘기다.
다만 올리타가 더 큰 전진을 하기 위해서는 갈 길이 여전히 멀다. 박 교수는 “올리타도 약효가 괜찮은 약이지만 글로벌 시장에서 선발주자인 아스트라제네카의 ‘타그리소’와 경쟁하려면 저렴한 가격 이외에 안전성 측면에서 경쟁력을 높일 필요가 있다”고 강조했다.
올리타는 지난달 15일부터 건강보험이 적용돼 환자들은 월 7만5,000원(약값 월 150만원)만 부담하면 된다. 이미 글로벌 3상을 마치고 시판 중인 타그리소(성분명 오시머티닙)는 환자 부담액이 월 34만원(약값 월 680만원)으로 올리타의 4.5배다. 월 1,000만원 이상의 약값 책정을 주장하던 아스트라제네카가 이 정도로 약값을 내린 것은 국산 신약 올리타가 있었기에 가능했다.
/임웅재기자 jaelim@sedaily.com
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >