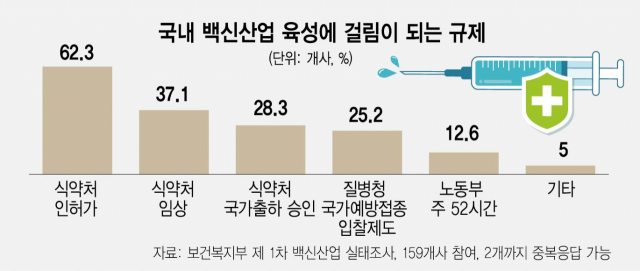
백신 개발사 10곳 중 6곳이 국내 백신 산업의 성장을 가로막는 요인으로 ‘식품의약품안전처의 인허가’를 꼽았다. 심사 과정에서 규제 기관의 자료 요청과 수정 요청이 많아 인허가 기간이 길어져 제품 출시가 지연되고 있다는 지적이다. 업계에서는 글로벌 트렌드에 맞춰 심사 인력을 대대적으로 보강하고, 절차를 간소화 해 허가 속도를 앞당겨야 한다고 입을 모으고 있다.
6일 보건복지부 주관으로 한국보건산업진흥원·한국제약바이오협회 등이 실시한 ‘2021년 국내 백신산업 실태조사’에 따르면 조사에 참여한 국내 백신기업 159개사 중 99개사(62.3%)가 백신산업 육성에 걸림이 되는 규제로 ‘식약처의 인허가 제도’라고 답했다. 이어 37.1%가 ‘식약처의 임상’을, 28.3%가 ‘식약처의 국가출하 승인'을 꼽았다.
인허가 제도·임상·국가출하 승인 제도는 모두 제품 출시 속도와 관련된 제도다. 대규모 투자를 통해 백신 개발에 나서도 규제 기관인 식약처가 심사·허가 속도가 더뎌 출시 타이밍이 늦춰지고 있는 것이다. 업계 한 관계자는 “미국은 규제 기관을 전폭적으로 지원해 1년 만에 백신 개발에 성공했다”며 “우리나라는 이런 지원이 부족해 1호 백신 출시까지 2년 반 가량 소요된 것을 보면 아쉬울 수 밖에 없는 상황”이라고 전했다. 또 다른 관계자는 “한국에서 승인을 받아야 다른 국가에서 승인을 받고 수출을 할 수 있는데, 이 과정이 지연되다보니 수출이 미뤄지는 경우가 다반사”라고 설명했다.
업계는 국내 백신산업 육성을 위한 지원 정책으로 인허가(RA) 인력 지원이 필요하다고 지적했다. 식약처는 이를 위해 올 4월 제품화전략지원단을 출범하기도 했다. 100명 규모로 △제품화지원팀 △혁신제품심사팀 △임상심사팀으로 지원단을 꾸려 임상 상담·설계·심사 등을 통합 지원하기 위해서다. 다만 업계에서는 여전히 인력이 부족하다는 아쉬움이 나온다. 100명 정도 규모의 심사 인력으로는 한국의 백신 산업 성장 속도를 지원하기에 충분치 않다는 것이다.
정부의 적극적인 연구개발(R&D) 투자가 필요하다는 목소리도 나왔다. 이번 조사에서 R&D분야의 애로사항으로 ‘자금 부족’(47.2%)이 가장 높은 순위를 차지했다. △연구개발 인력부족(25.2%) △연구장비 등 인프라 부족(22%) △백신 원부자재 확보 어려움(15.7%) 등이 뒤를 이었다.
지난해 백신산업의 국내 매출액은 총 3조 4178억 원으로 조사됐다. 분야별로는 백신 완제품 2조 6865억 원, 백신 원부자재 865억 원, 백신 장비 694억 원, 백신 관련 서비스업 6391억 원이다. 수출액은 국내 매출액의 20% 수준인 6287억 원으로 집계됐다. 복지부 관계자는 “이번 실태 조사에서 나온 백신 개발 기업들의 애로사항을 적극 수렴해 향후 정책을 수립할 때 반영할 수 있도록 조치하겠다”고 말했다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >









 econ_jun@sedaily.com
econ_jun@sedaily.com







































