JW중외제약(001060)이 개발 중인 통풍 치료제 ‘에파미뉴라드(URC102)’ 처방 대상이 일반인은 물론 신장 장애를 앓고 있는 환자로까지 확대될 전망이다.
JW중외제약은 19일 신장애 환자를 대상으로 한 에파미뉴라드 임상 1상 시험에서 안전성을 확인하는데 성공했다고 밝혔다. 회사측은 “지난해 12월부터 올해 12월까지 신장애 환자 15명, 건강한 성인 12명 대상 추가 임상 1상을 진행한 결과 중등증 신장애 환자와 건강한 성인 모두에게서 우수한 내약성과 안전성을 확인했다”며 “두 그룹 간 약동학·약력학적 특성도 유의미한 차이가 없었다”고 설명했다.
에파미뉴라드는 요산트랜스포터-1(URAT1)을 억제하는 기전의 요산 배설 촉진제다. 혈액 내에 요산 농도가 비정상적으로 높은 고요산혈증으로 인한 통풍 질환에 유효한 신약 후보물질로, 먹는 약으로 개발 중이다.
JW중외제약 관계자는 “이번 임상시험에서 중등증 신장애를 앓고 있는 통풍 환자에게도 일반 성인과 동일한 용법·용량으로 에파미뉴라드를 투약할 수 있다는 점과 식전·식후 상관없는 복약 편의성을 확인했다”며 “미충족 의료 수요가 매우 큰 통풍치료제 시장에서 에파미뉴라드를 계열 내 최고 신약(베스트-인-클래스)으로 개발해 나갈 것”이라고 말했다.
JW중외제약은 이번 임상 결과를 바탕으로 적용 대상을 일반 통풍 환자에 신장애 환자까지 더해 글로벌 3상을 추진할 계획이다. 임상 3상은 한국과 대만, 유럽에서 총 588명의 통풍 환자를 대상으로 진행한다. 지난달 24일 식품의약품안전처로부터 다국가 임상시험계획(IND)를 승인받았다. 대만식품의약품청(TFDA)에는 이달 16일 임상시험계획을 신청했고 유럽 허가기관에는 내년 상반기 IND를 제출할 계획이다. JW중외제약은 2019년 중국 심시어제약에 중국·홍콩·마카오 시장에 대한 에파미뉴라드 개발·판매 권리를 기술 수출한 데 이어 현재는 중국을 제외한 글로벌 기술이전을 추진하고 있다.
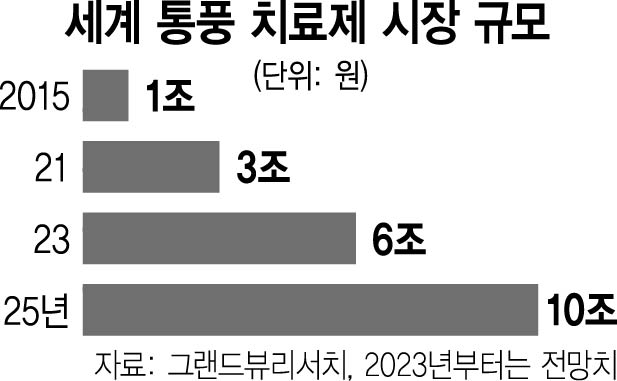
한편 글로벌 시장조사 기관인 그랜드 뷰 리서치에 따르면 현재 3조 원 규모인 통풍 치료제 시장은 2025년 10조 원 규모로 성장할 것으로 전망된다. 한국도 식생활 서구화에 따라 통풍 환자가 2015년 33만 4705명에서 2021년 기준 49만 2373명으로 급증하는 추세다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >