셀트리온(068270)이 자체 개발한 바이오시밀러(바이오복제약) 허가를 유럽에서 또 받았다. 유럽에서만 이번이 세 번째 허가다.
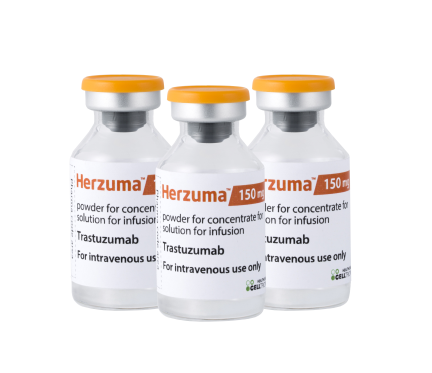
셀트리온은 유방암 치료용 바이오시밀러 ‘허쥬마’가 유럽의약품청(EMA)으로부터 판매허가 승인을 받았다고 14일 밝혔다. 셀트리온은 앞서 지난해 12월 EMA 산하 약물사용자문위원회(CHMP)로부터 긍정 의견을 받았으며 이번에 정식 승인을 얻어 유럽 시장 진출의 최종 관문을 모두 통과했다. 허쥬마의 오리지널 의약품은 글로벌 제약사 제넨텍이 개발하고 로슈가 판매하는 ‘허셉틴’이다. 허셉틴은 지난해에만도 약 67억5,100만달러의 매출을 기록해 전 세계에서 가장 많이 팔린 의약품 8위에 이름을 올렸다. 허쥬마는 선발 제품인 자가면역질환 치료용 바이오시밀러 ‘램시마’와 혈액암 치료용 바이오시밀러 ‘트룩시마’에 이어 유럽 시장에 진출하는 셀트리온의 세 번째 바이오시밀러 제품이 된다.
셀트리온은 지난 2014년 1월 식품의약품안전처로부터 허쥬마에 대한 허가를 받으며 세계 최초로 상용화에 성공했다. 하지만 유럽 진출은 지난해 11월 세계 첫 허셉틴 바이오시밀러로 승인받은 삼성바이오에피스의 ‘온트루잔트’에 이어 두 번째다. 허가신청이 삼성바이오에피스보다 1개월가량 늦었고 중간에 EMA가 추가 자료를 요구하면서 최종 허가가 더 지체됐다. 대신 셀트리온은 미국 허셉틴 바이오시밀러 시장에서 삼성바이오에피스보다 먼저 허가를 신청한 만큼 승기를 잡을 것으로 예상하고 있다.
셀트리온 관계자는 “‘허쥬마’는 이미 주요 글로벌학회에서 약효의 우수성과 안전성이 입증돼 의료진의 신뢰를 확보한 바이오의약품”이라며 “앞서 유럽에 출시한 자가면역질환 치료제 램시마와 혈액암 치료제 트룩시마가 시장을 급격히 확대하고 있어 유방암 치료제 시장에서도 가시적인 성과를 거둘 것”이라고 말했다. /이지성기자 engine@sedaily.com
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >