신약개발기업 카이노스메드(284620)가 파킨슨병 신약후보물질 ‘KM-819’의 미국 2상 임상 시험에서 안전성이 확인돼 신약 개발에 파란 불이 켜졌다. 카이노스메드 주가는 이 소식이 알려지면서 개장 직후 급등해 가격제한폭까지 오르며 4975원에 거래를 마쳤다.
카이노스메드는 자회사 패시네이트를 통해 미국에서 진행 중인 파킨슨병 신약후보물질 KM-819 임상 2상 시험의 파트1 A에서 부작용이 없음을 확인했다고 19일 밝혔다.
패시네이트는 지난해 11월 미국식품의약국(FDA)으로부터 다계통위축증과 파킨슨병 등에 관한 KM-819의 2상 임상 시험을 승인 받고 미국 로스엔젤레스의 파렉셀 임상센터에서 임상 시험을 진행했다. 미국 2상은 파트1과 파트2로 구성된다. 파트1에서는 사람 대상으로 시험약을 안전하게 투약할 수 있는 최대 용량을 선정하기 위해 건강한 사람(파트1 A)과 파킨슨병 환자(파트1 B)를 대상으로 용량별 안전성 및 약동학을 확인한다. 파렉셀 임상센터는 건강한 노인 18명을 대상으로 KM-819 400~800mg을 각각 1주일씩 순차 투여해 안전성과 약동학 평가를 진행한 결과 모든 용량에서 부작용이 나타나지 않았다. 패시네이트는 파킨슨병 환자 24명을 대상으로 KM-819 2상 임상 시험의 파트1B를 진행할 계획이다. 캘리포니아 소재의 샌디에이고대학병원과 미시간주 소재 큐알아이임상연구센터에서 KM-819 200~600mg을 순차 투여하고 안전성 및 약동학 평가를 진행할 예정이다.
이재문 카이노스메드 사장은 "파트 1B 임상이 성공하면 안전한 최적의 용량을 결정해 임상 2상의 주요 평가항목인 유효성을 확인할 계획"이라며 "KM-819의 기술이전을 포함해 글로벌 탑 제약사들과 공동개발 업무협력 체계 구축을 위한 협의도 긴밀하게 논의 중"이라고 말했다.
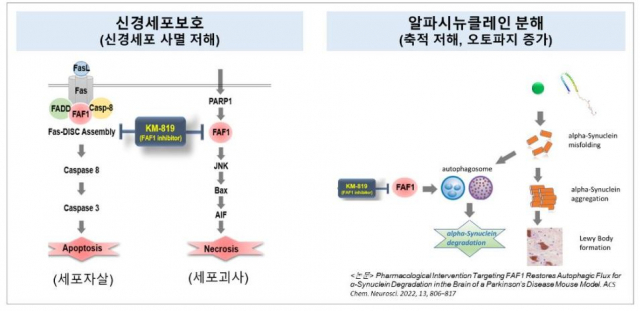
카이노스메드가 개발 중인 KM-819는 세포의 사멸을 촉진하는 단백질 'FAF1'을 저해하는 기전의 신약 후보물질이다. 도파민 분비 신경세포의 사멸에 관여하는 FAF1 단백질의 과활성을 억제하는 동시에 자가포식(autophagy) 활성을 증가시켜 알파시누클레인의 응집을 억제하는 이중기전으로 작용한다.
시장조사기관 MARC에 따르면 세계 파킨슨병 치료제 시장 규모는 2020년 약 8조 원에서 2026년에는 11조 원에 달할 것으로 예상된다. 아직 증상을 완화하는 수준의 치료제만 있고 근본적인 치료가 불가능해 전 세계적으로 신약에 대한 미충족 수요가 높다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >









 realglasses@sedaily.com
realglasses@sedaily.com